
2023年全球基因药物临床试验注册超过70个,显示这一赛道正日益受到青睐。
日前,沙利文发布《基因药物行业现状与发展趋势蓝皮书》(下称《蓝皮书》)预测,基于我国庞大的慢性病、肿瘤患者人群,作为创新疗法的基因药物可以通过对致病基因进行干预,恢复其正常表达水平,有望实现“一次治疗,终身治愈”。
《蓝皮书》称,截至2023年11月,全球共有12款基因药物获批上市,治疗领域覆盖肿瘤、血液系统疾病、神经系统疾病、眼科等。ClinicalTrials临床试验数据库的检索结果显示,2018年起,基因药物赛道热度提升,每年有超40个临床试验注册,并于2023年超过70个。
基因治疗,指通过修改或控制基因的表达来达到治疗疾病的目的,这涉及遗传物质的转录、翻译等;按类型可分为基因药物、基因修饰细胞、溶瘤病毒等。
关于基因药物研发,《蓝皮书》提出6大核心要素,包括:递送系统的安全性、基因编辑的安全性、基因表达调控、精准靶向病灶、规模化生产和产品质量控制。
对于基因药物的现存挑战,多位业内人士认为,价格昂贵是最大难题。其他挑战则包括基因药物的脱靶、编辑效率、CMC(化学成分生产与控制)成本、可及性等。
本导基因创始人蔡宇伽称,基因药物的价格昂贵会直接限制其临床推广和使用,“除了罕见病领域,基因药物要拓展诸如神经系统疾病、实体瘤、重大病毒感染性疾病(乙肝、疱疹等感染)等领域。”
天泽云泰临床前和转化研究负责人朱晰表示,基因药物价格昂贵在于其研发成本无法分摊,“研发人员需要为基因药物找到更多适应证,来分摊研发成本,但基因药物作为一种创新技术路线,其供应链(包括载体填料、培养基等)的不足需要时间去完善。”
面对上述挑战,基因药物企业该如何做?《蓝皮书》撰写团队负责人、沙利文大中华区生命科学事业部咨询总监李谦告诉记者,一方面,随着研究深入,基因药物正逐渐向其它疾病扩展适应证;另一方面,病毒载体的进一步优化将使得基因药物的递送系统向着高效、安全、低免疫原性的方向发展。此外,多元化支付模式也可以促使基因药物在支付端更具有商业化能力。
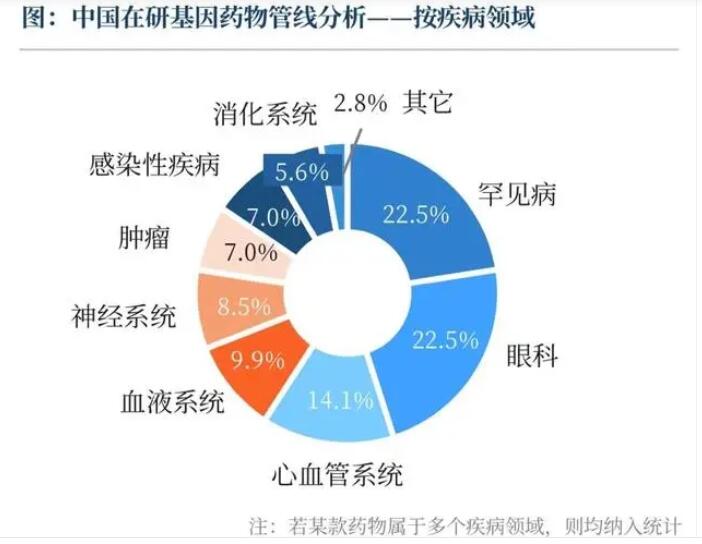
(图为中国在研基因药物管线分析-按疾病领域,来源《蓝皮书》)
我国基因药物企业的竞争格局如何?李谦表示,截至2023年10月31日,我国基因药物在研管线主要布局在罕见病和眼科领域,两者占比相当,均为22.5%;而研发阶段上,则主要集中在临床I期、I/II期的早期阶段,少数管线进入了III期临床。
“尽管我国已有数款基因修饰细胞产品获批,但没有基因编辑药物上市,多家公司仍在布局BE(单碱基编辑)、PE(先导编辑)等技术。未来,我国有望迎来基因编辑药物获批上市。”李谦介绍道。